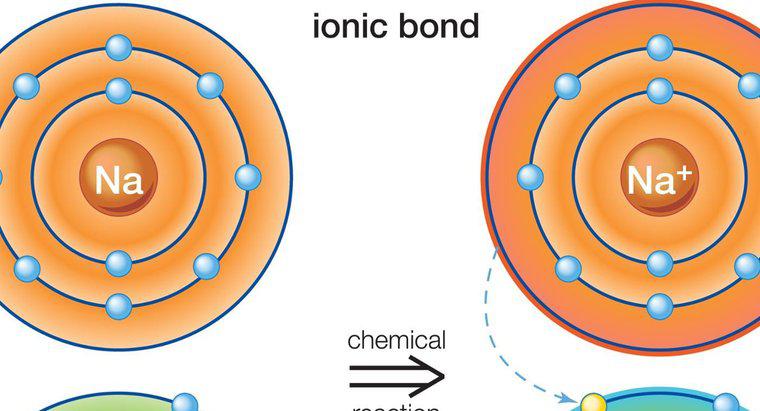
Die Benennung ionischer Verbindungen erfordert die korrekte Identifizierung der vorhandenen Kationen- und Anionenspezies. In bestimmten Fällen ist die Ladung des Ions für eine genaue Benennung wichtig.
Standardmäßige chemische Benennungsprinzipien identifizieren das Kation zuerst im Namen und das Anion dann. In ionischen Verbindungen ist das Kation typischerweise ein Metall, und der erste Teil des Namens der Verbindung ist einfach dieses Metall. Wenn das Kation natürlicherweise in mehreren geladenen Zuständen vorkommen kann, sollte die Ladung des Metalls, auch Valenz genannt, im Verbindungsnamen mit römischen Ziffern identifiziert werden. Eisen kann beispielsweise im positiven zwei- oder dreifach geladenen Zustand vorliegen. Diese würden Eisen (II) bzw. Eisen (III) heißen.
Der letzte Schritt bei der Benennung einer ionischen Verbindung besteht darin, das vorhandene Anion richtig zu identifizieren. Anionen können ein einzelnes Ion sein, z. B. Bromid, oder komplexe Moleküle, die aus mehreren Atomen bestehen, z. B. Sulfat. Für diese komplexen Anionen gibt es zusätzliche Benennungsparameter. Elemente, die mehrere Oxyanionen bilden können, wie Stickstoff und Schwefel, haben je nach Anzahl der vorhandenen Sauerstoffmoleküle entweder eine -ite- oder eine -ate-Endung. Ein Beispiel für eine richtig benannte ionische Verbindung ist Eisen(II)sulfat für die ionische Formel Fe(SO4).