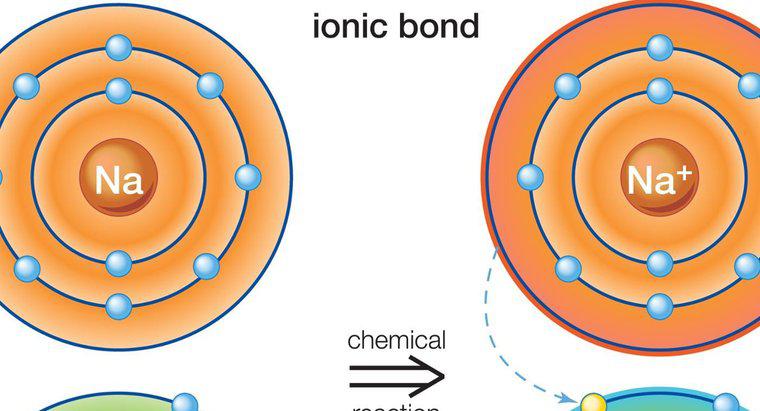
Ionenbindung umfasst ein Metall und ein Nichtmetall. Dies liegt daran, dass die Ionenbindung die Übertragung von Valenzelektronen beinhaltet. Die resultierende Bindung erzeugt zwei entgegengesetzt geladene Ionen.
Ionische Bindungen treten zwischen Metallen und Nichtmetallen auf, da Metalle im äußersten Ring nur wenige Elektronen haben. Dies macht Metalle eher bereit, Elektronen zu verlieren, da dies dazu führt, dass das Ion eine stabile Konfiguration erhält. Einige Nichtmetalle haben fast acht Elektronen und benötigen mehr Elektronen, um eine Edelgaskonfiguration zu erhalten.
Elemente können mehr als ein Elektron teilen. Wenn ein Element zunimmt und ein anderes verliert, führt dies dazu, dass ein Element positiv und das andere negativ geladen wird. Ob das Element positiv oder negativ wird, hängt davon ab, ob sie Elektronen verloren oder aufgenommen haben. Ein Verlust führt zu einer positiven Ladung, während ein zusätzliches Elektron zu einer negativen Ladung führt. Die Nettoladung in der Verbindung muss null sein. Da es immer das Metall ist, das Elektronen spendet, ist das Metallelement positiv und das Nichtmetallelement negativ.
Ein Beispiel für eine ionische Bindung ist die Verbindung Natriumchlorid, die allgemein als Kochsalz bekannt ist. Natrium enthält in seinem äußersten Ring ein Elektron, während Chlor sieben enthält. Das Natrium überträgt sein Elektron auf das Chlor und wird positiv geladen, während das Chlor negativ geladen wird. Die Nettoladung der Verbindung ist null, da sich die beiden Elemente verbunden haben.