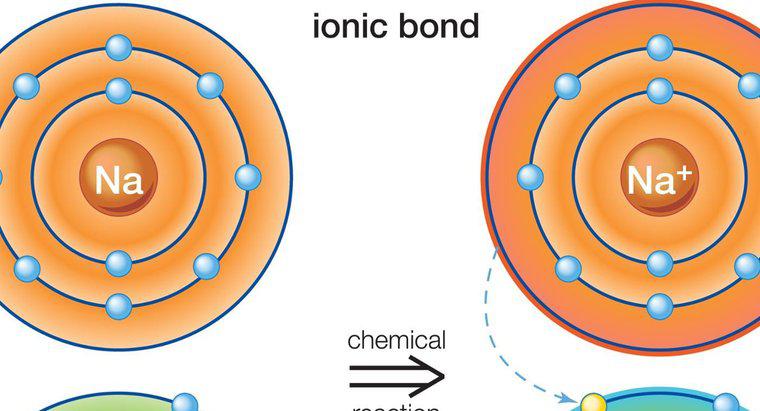
Ionische Verbindungen sind Feststoffe, besitzen hohe Schmelzpunkte, leiten Elektrizität, sind hart, aber spröde und werden aus einer ionischen Bindung zwischen einem Metall und einem Nichtmetall gebildet. Eine ionische Bindung ist eine Bindung zwischen zwei Elementen mit gegenteiligen Gebühren. Die gegensätzlichen Ladungen ziehen sich gegenseitig an und schaffen eine starke chemische Bindung.
Ionische Verbindungen lösen sich leicht in polaren Lösungsmitteln wie Wasser. Sie lösen sich nicht leicht in unpolaren Lösungsmitteln, zu denen Ether und Benzin gehören. Dies liegt daran, dass ionische Verbindungen dazu neigen, polare Moleküle zu bilden, die sich in Lösungen ähnlicher Polarität auflösen. Ein unpolares Lösungsmittel liefert nicht genug Energie, um die Ionenbindung aufzubrechen und die kristalline Struktur der Verbindung aufzulösen.
Die leitfähigen Eigenschaften ionischer Verbindungen gelten, wenn sie in einer ionischen Lösung gelöst oder geschmolzen werden. Wenn ionische Verbindungen fest sind, sind sie eher elektrische Isolatoren als Leiter. Dies liegt daran, dass elektrische Ladungen die enge Gitterstruktur einer ionischen Verbindung im festen Zustand nicht passieren können.
Natriumchlorid, auch als Kochsalz bekannt; Kaliumchlorid, das in der Medizin und als Salzersatz verwendet wird; und Korund, das Mineral, aus dem Rubine und Saphire bestehen, sind bekannte ionische Verbindungen. Alle diese Verbindungen bilden Kristallstrukturen, ein weiteres gemeinsames Merkmal ionischer Verbindungen.