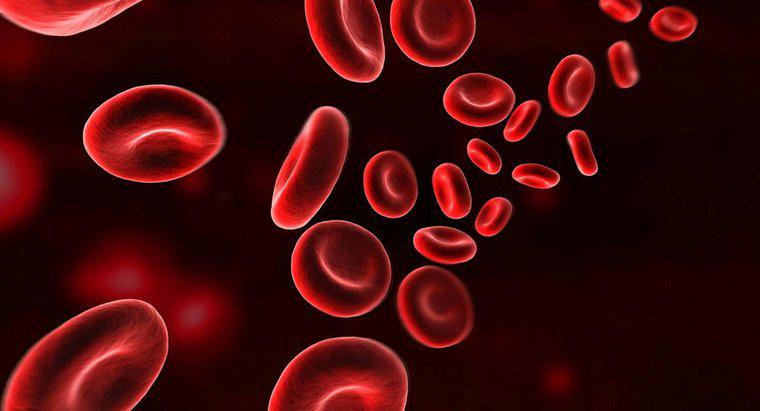
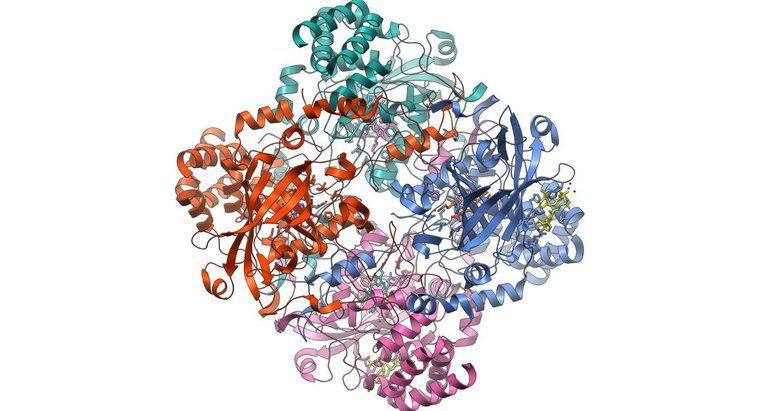
Hämoglobin bindet Sauerstoff, indem es auf atomarer Ebene rostet. Das Hämoglobinmolekül in roten Blutkörperchen wird vom Office of Science des US-Energieministeriums als "Metalloprotein" bezeichnet. Das heißt, es ist ein Protein, das etwas Metall, in diesem Fall Eisen, in seine Struktur einbaut. Jedes Hämoglobinmolekül trägt vier gebundene Eisenatome, die zusammenarbeiten, um Sauerstoff aus der Lunge, wo er reichlich vorhanden ist, in andere Körperteile zu transportieren.
Laut der Website des National Center for Biotechnology Information reagieren die vom Hämoglobin getragenen Eisenatome auf die gleiche Weise wie Eisen normalerweise auf die Anwesenheit von Sauerstoff, indem sie sich in einem Prozess namens Oxidation daran binden. Die resultierende Verbindung, Eisenoxid, wird als Rost bezeichnet, wenn sie außerhalb des Körpers gefunden wird. In den roten Blutkörperchen halten diese oxidierten Hämoglobinmoleküle ihre Sauerstofffracht, bis sie einen Teil des Körpers erreichen, der nicht genügend Sauerstoff hat, wo er dann freigesetzt wird.
Derselbe Artikel stellt fest, dass die vier Untereinheiten des Hämoglobinmoleküls zusammenarbeiten, um Sauerstoff in sauerstoffreichen Umgebungen sehr effizient zu binden, aber die Wirkung schwächt sich in sauerstoffarmen Umgebungen ab. Diese ungleichmäßige Reaktion macht Hämoglobin begierig darauf, sich mit Sauerstoff in der Lunge zu verbinden und sich in Anwesenheit einer sauerstoffhungrigen Zelle ebenso davon zu trennen, woraufhin der Zyklus von vorne beginnt.