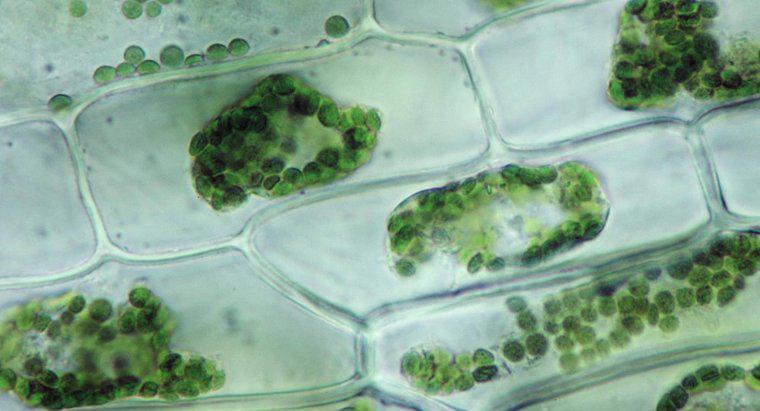
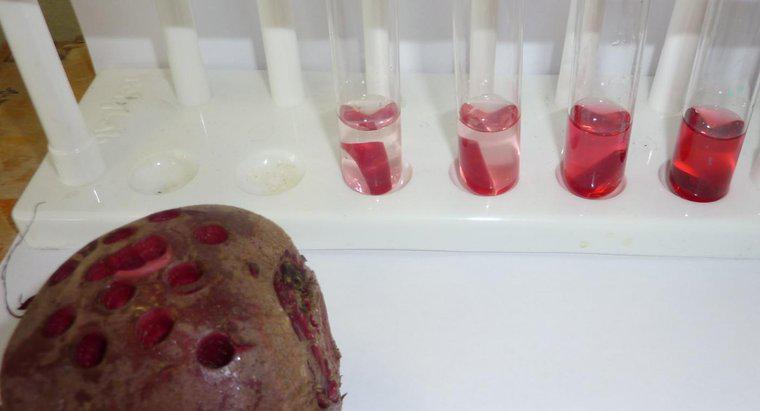
Osmose ist eine besondere Art der Diffusion, bei der Wasser eine semipermeable Membran zu einem Bereich mit einer höheren Konzentration an gelösten Stoffen durchquert, während die Standarddiffusion oft die freie Bewegung von gelösten Stoffen und Lösungsmitteln in Richtung Gleichgewicht ermöglicht. Diffusion ist im Allgemeinen die Nettobewegung von Molekülen in Lösung von Bereichen höherer Konzentration zu Bereichen niedrigerer Konzentration. Der osmotische Druck ist potenziell sehr stark, wobei der osmotische Druck die einzige Kraft ist, die erforderlich ist, um Wasser von den Wurzeln bis zu den Spitzen der höchsten Bäume der Welt zu bewegen.
Wenn Wasser eine andere Substanz auflöst, liegt das daran, dass sich die polaren Wassermoleküle und der gelöste Stoff gegenseitig anziehen. Jedes Atom, Ion oder Molekül des gelösten Stoffes hat eine Ladung in mindestens einer Region, die die eine oder andere Seite des Wassermoleküls anzieht. Daher neigen so viele Wassermoleküle wie möglich dazu, sich um jedes Lösungsmittelpartikel zu sammeln. In flüssigem Wasser befinden sich alle Moleküle in ständiger, zufälliger Bewegung umeinander. Aufgrund der Anziehung bewegen sich die Wassermoleküle jedoch etwas wahrscheinlicher zu Partikeln des gelösten Stoffes als von ihnen weg, und Partikel des gelösten Stoffes bewegen sich eher zu Wassermolekülen als andere Partikel des Lösungsmittels. Diese Nettobewegung führt nach und nach zu einer gleichmäßigen Verteilung des gelösten Stoffes. Bei der Osmose können sich nur die Wassermoleküle bewegen, um die Konzentration auszugleichen.