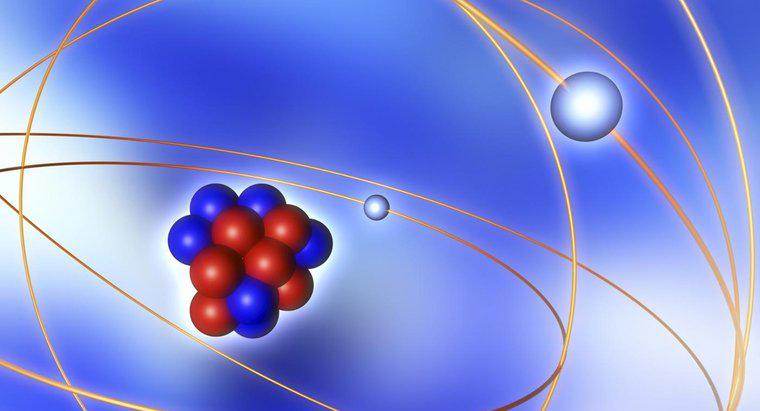
Der Kern eines Atoms enthält Neutronen und Protonen. Protonen sind positiv geladen, während Neutronen neutral sind. Elektronen sind zwar Teil des Atoms, aber nicht Teil des Kerns.
Atome sind elektrisch neutral, was bedeutet, dass sie die gleiche Menge an negativer und positiver Ladung haben. Die Nettoladung des Atomkerns ist wegen der positiven Protonen positiv. Um dem entgegenzuwirken, umkreisen negativ geladene Elektronen den Kern.
Ein neutrales Atom hat die gleiche Anzahl von Protonen wie Elektronen. Im Gegensatz zu Protonen kann die Anzahl der Neutronen im Kern variieren. Ein Atom, das die richtige Menge an Protonen und Elektronen enthält, aber mit einer anderen Anzahl von Neutronen im Kern, wird als Isotop bezeichnet.
Der größte Teil der Masse eines Atoms befindet sich im Kern. Elektronen sind viel leichter als Protonen und Neutronen.
Obwohl ein Kern den größten Teil der Masse eines Atoms enthält, ist er im Vergleich zur Gesamtgröße des Atoms sehr klein. Dies liegt daran, dass die Protonen und Neutronen durch die Kernkraft eng zusammengehalten werden. Ohne diese Kernkraft würden sich die positiven Protonen gegenseitig abstoßen und der Kern würde nicht existieren. Wenn die Kernkraft zu schwach ist, bricht der Kern auf, was zu radioaktiven Emissionen führt.