Wasserstoffbrücken beinhalten die Dipolverschiebungen, die durch polare Bindungen erzeugt werden, und tritt zwischen Molekülen auf, die polare Bindungen enthalten. Wasserstoff ist speziell beteiligt, weil das Element eine niedrige Elektronegativität für ein Nichtmetall hat und eine große Dipolverschiebung erzeugt, die stark genug ist, um andere elektronegative Atome von polaren Bindungen in anderen Molekülen anzuziehen.
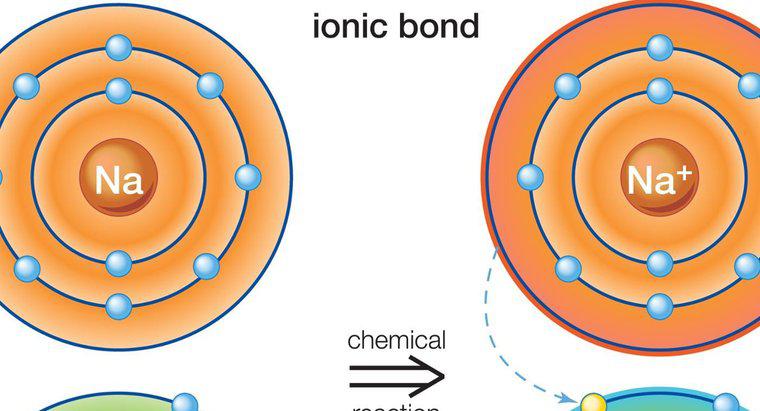
Polare kovalente Bindungen bilden sich, wenn die zwei Atombindungen einen Unterschied in der Elektronegativität aufweisen, der signifikant genug ist, um eine Ladungsverschiebung zu erzeugen, aber geringer ist als der erforderliche Unterschied, um eine Ionenbindung zu bilden. Bei einer polaren kovalenten Bindung teilen sich die Atome die Elektronen ungleichmäßig. Dies erzeugt eine Dipolverschiebung und verleiht einem Ende eine leicht positive Ladung und dem anderen eine leicht negative Ladung.
Wenn Wasserstoff an einer polaren Bindung beteiligt ist, wird er leicht positiv geladen und zieht negativ geladene Dipole von anderen Molekülen an. Das andere Molekül muss nicht insgesamt polar sein, aber es muss polare Bindungen aufweisen, um die Dipole zu bilden, die die Wasserstoffladungen anziehen oder abstoßen. Wasserstoffbrückenbindungen sind eine schwächere Form der Bindung als ionische oder kovalente Bindungen, aber signifikant genug, um einzigartige Eigenschaften und Anziehungskräfte zu erzeugen, wie sie zwischen Wassermolekülen beobachtet werden.