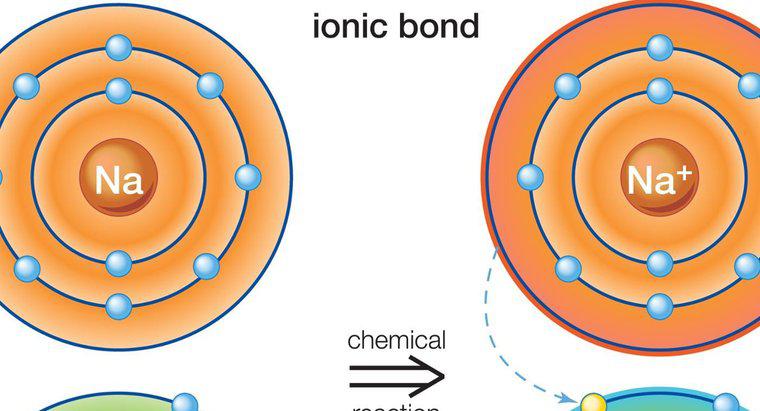
Das anorganische Salz Natriumjodid weist eine ionische Bindung auf. Eine ionische Bindung ist die stärkste der chemischen Bindungen und gibt beim Aufbrechen die meiste Energie ab. Die anderen Arten chemischer Bindungen umfassen kovalente und polare kovalente Bindungen, Wasserstoffbindungen und Van-der-Waal-Kräfte.
In einer Ionenbindung ist eines der Atome ein starker Elektronendonor und das andere Atom ein starker Elektronenakzeptor. Halogene wie Jod sind stark elektronegativ und nehmen ein Elektron von einem anderen Atom auf, um dessen äußeres Orbital vollständig mit acht Elektronen zu füllen, was ein stabiler atomarer Zustand ist. Alkalimetalle wie Natrium sind starke Elektronendonatoren mit einem äußeren Orbitalelektron. Dieses Elektron wird schnell abgegeben, sodass das äußere Orbital des Metalls ebenfalls acht Elektronen hat.