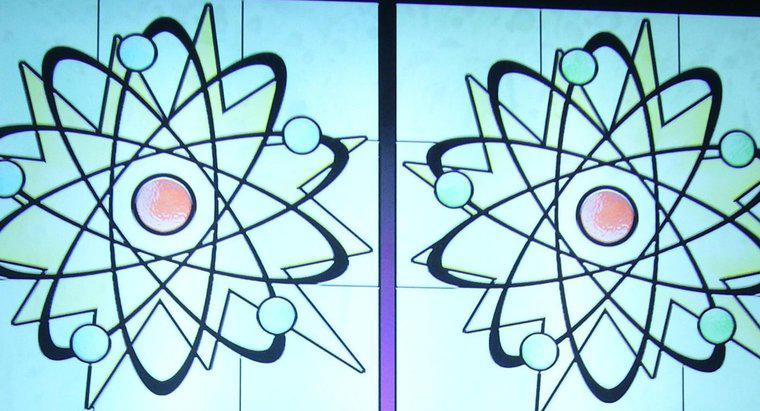
Die Ordnungszahl eines Atoms ist die Anzahl der Protonen, die sich im Kern befinden, während die Massenzahl die Anzahl der Protonen und Neutronen zusammen ist. Die Ordnungszahl bestimmt die Art des Elements eines Atoms , während die Neutronenzahl das Isotop des Elements bestimmt. Viele Elemente kommen in der Natur in Form mehrerer verschiedener Isotope vor.
Alle Atome haben einen Kern, der aus einem Cluster von Protonen und Neutronen besteht, sowie eine Elektronenwolke, die den Kern umgibt. Protonen sind positiv geladene Teilchen, Neutronen sind Teilchen ohne Ladung und Elektronen sind Teilchen mit negativer Ladung.
In den meisten Fällen ist die Nettoladung eines Atoms neutral, da Protonen und Neutronen in identischen Mengen vorkommen. Wenn ein Atom ein Elektron aufnimmt oder verliert, wird das Atom zu einem geladenen Ion. Geht ein Elektron verloren, wird das Atom positiv geladen; Wenn es jedoch ein Elektron aufnimmt, wird das Atom negativ geladen.
Wenn ein Atom ein Neutron verliert und zu einem Isotop wird, können seine Eigenschaften von denen der natürlichen Konfiguration abweichen. Häufig durchlaufen Atome, die radioaktiv sind, einen Zerfallsprozess, der dazu führt, dass das Atom seine Neutronen verliert.