Ionische und molekulare Verbindungen unterscheiden sich hauptsächlich in der Art und Weise, wie sie gebildet werden. Ionische Verbindungen entstehen durch die Übertragung von Elektronen, während sich molekulare Verbindungen durch Elektronenaustausch bilden.
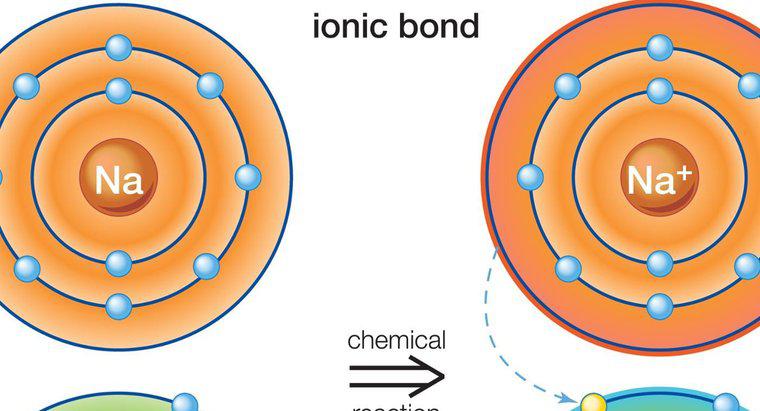
Ionische Verbindungen enthalten Atome und Moleküle mit entgegengesetzten Ladungen. Sie verbinden sich aufgrund ihrer gegensätzlichen Ladungen. Zum Beispiel verbindet sich ein negativ gepaartes Ion mit einem positiven Ion. Atome und Moleküle mit gleicher Ladung stoßen sich gegenseitig ab. Moleküle mit positiver Ladung werden als Kationen bezeichnet, Moleküle mit negativer Ladung als Anionen.
Ionische Verbindungen
Ionische Verbindungen entstehen dadurch, dass Atome oder Moleküle mehr Atome oder Moleküle mit entgegengesetzter Ladung anziehen. Die Zusammensetzung variiert je nach Art der Verbindung, aber alle ionischen Verbindungen müssen eine neutrale elektrische Ladung haben. Das bedeutet, dass sie ein gleiches Verhältnis von anionischen und kationischen Molekülen aufweisen müssen.
Ionische Verbindungen sind normalerweise fest. Sie können aus einzelnen Atomen bestehen, die als einatomige Verbindungen bezeichnet werden, oder aus mehreren Atomen, was sie zu mehratomigen Verbindungen macht. Die ionische Bindung, die ionische Moleküle bildet, beinhaltet die Übertragung von Elektronen von Metallen auf Nichtmetalle. Metalle neigen dazu, positive Elektronen leicht zu verlieren, weil sie wenige Elektronen in ihrem äußeren Energieniveau haben. Nichtmetalle haben mehr negative Elektronen in ihrem äußeren Energieniveau. Als Ergebnis suchen sie nach positiven Ionen und binden sich auf natürliche Weise mit metallischen Molekülen. Die meisten mehratomigen Verbindungen sind anionisch, mit Ausnahme des Ammoniumkations. Ionische Verbindungen unterscheiden sich von molekularen Verbindungen dadurch, dass sie sich aus Metallen und Nichtmetallen bilden können, während sich molekulare Verbindungen nur aus Nichtmetallen bilden können. Übliche Arten von ionischen Verbindungen sind Salz und Zucker.
Molekulare Verbindungen
Molekulare Verbindungen, auch kovalente Verbindungen genannt, teilen Elektronen, indem sie kovalente Bindungen bilden. Während ionische Verbindungen aus metallischen und nichtmetallischen Atomen und Molekülen bestehen können, können sich kovalente Bindungen nur aus nichtmetallischen Atomen und Molekülen bilden. Eine kovalente Verbindung entsteht, wenn Atome innerhalb verschiedener Elemente durch Moleküle kombiniert werden. Diese Bindung ermöglicht die gemeinsame Nutzung von Valenzelektronen, wodurch eine gemeinsame Anziehung entsteht, die die Atome im Molekül zusammenhält.
Kovalente Verbindungen variieren beträchtlich in der Größe. Einige sind klein, mit nur wenigen Elementen, während andere Tausende von Atomen haben können. Da sie Elektronen teilen, anstatt sie auszutauschen, haben kovalente Verbindungen erheblich andere Eigenschaften als ionische Verbindungen. Kovalente Verbindungen neigen dazu, leicht zu brennen, während ionische Verbindungen dies nicht tun. Im Gegensatz zu ionischen Verbindungen sind sie nicht wasserlöslich. Ein weiterer Unterschied zwischen den beiden Arten von Molekülen besteht darin, dass kovalente Verbindungen keinen Strom leiten können, ionische Verbindungen jedoch im Allgemeinen. Bei Raumtemperatur liegen die meisten kovalenten Verbindungen in flüssiger oder gasförmiger Form vor, anstatt als Feststoffe zu erscheinen. Dies liegt daran, dass sich ihre einzelnen Moleküle leichter trennen lassen als Moleküle in einem Kristall, was ihnen einen relativ niedrigen Siedepunkt verleiht. Einfache molekulare Verbindungen haben die gleiche Namensstruktur. Sie werden im Periodensystem gefunden, indem zuerst das Element benannt wird, das am weitesten links in der Tabelle erscheint, dann "ide" zum zweiten benannten Element hinzufügt und Präfixe verwendet werden, um die Anzahl der Atome in jedem Element zu identifizieren. Proteine und Kohlenhydrate sind zwei Beispiele für molekulare Verbindungen. Andere molekulare Verbindungen sind Methangas, Stickoxide und Natriumchlorid.