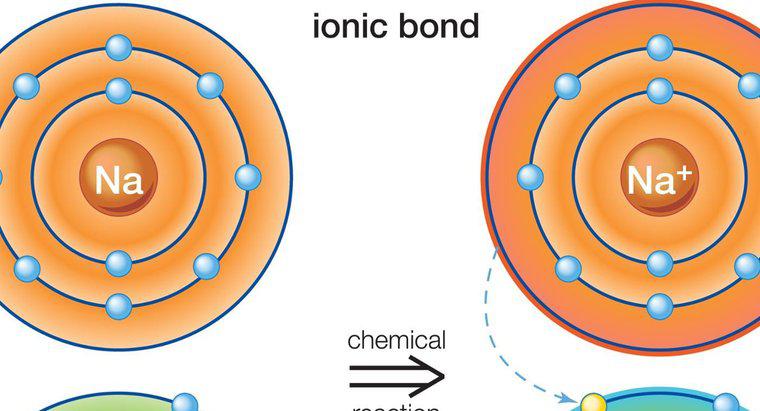
Ionische Verbindungen sind elektrisch neutral, da sich die Ladungen der Kationen und Anionen, aus denen die Verbindung besteht, gegenseitig aufheben. Im Fall von Salz beispielsweise hat Natrium eine positive Ladung und Chlorid hat eine negative Ladung. Zusammen neutralisieren sie die Verbindung.
Ionische Verbindungen bestehen aus positiv und negativ geladenen Atomen oder Molekülen. Diejenigen mit positiver Ladung werden als Kationen bezeichnet, während diejenigen mit einer negativen Ladung als Anionen bezeichnet werden. Die beiden werden aufgrund ihrer gegensätzlichen Ladungen zueinander angezogen. Kationen und Anionen können mehr als ein Molekül des entgegengesetzten Typs anziehen, wodurch ein längeres Molekül entsteht, das durch Ionenbindungen zusammengehalten wird.
Calciumchlorid ist ein weiteres Beispiel für eine ionische Verbindung, bei der das positive Calcium das negative Chlorid aufhebt. Eisenbromid tut dasselbe, wobei die positive Ladung des Eisens die negative Ladung des Bromids aufhebt. Diese elektrische Neutralität trägt dazu bei, die Verbindung stabil zu halten, wodurch sie einfacher zu verarbeiten und viel weniger flüchtig als instabile Ionen ist.
Die meisten ionischen Verbindungen sind Feststoffe mit hohen Schmelzpunkten. Sie werden oft aus einem Metall- und einem Nichtmetallelement gebildet. Verbindungen, die aus zwei Nichtmetallen bestehen, sind oft kovalent gebundene Verbindungen.