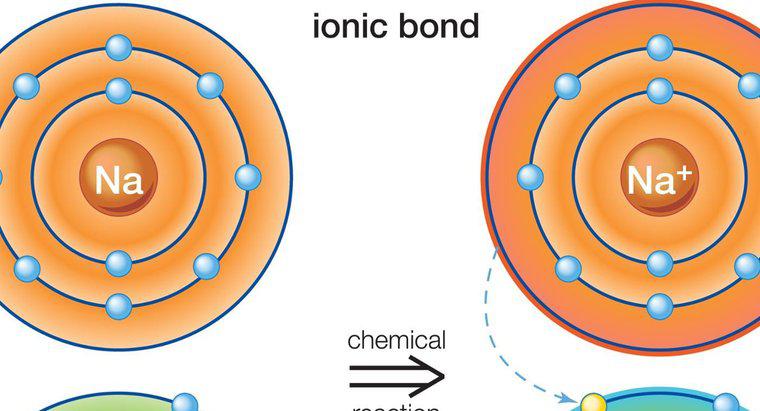
Da sie das Ergebnis der Anziehung von Teilladungen und nicht von Vollladungen sind, sind Wasserstoffbrückenbindungen viel schwächer als ionische oder kovalente Bindungen. Ionische und kovalente Bindungen ziehen die Atome verschiedener Substanzen zusammen und bilden die Moleküle von Verbindungen, während Wasserstoffbrücken Kräfte sind, die dazu neigen, Moleküle anzuziehen. Ein Beispiel für Wasserstoffbrückenbindungen ist die Anziehung zwischen einzelnen Wassermolekülen, während die Anziehungskraft zwischen den Wasserstoff- und Sauerstoffatomen in jedem Wassermolekül eine kovalente Bindung darstellt.
Eine Wasserstoffbrücke entsteht, wenn ein positiv polarisiertes Wasserstoffatom in einem Molekül von einem stark elektronegativen Atom in einem anderen Molekül angezogen wird. Im Beispiel der Wassermoleküle zieht das negativ geladene Sauerstoffatom in einem Wassermolekül das positiv geladene Wasserstoffatom in einem anderen Wassermolekül an. Sauerstoffatome neigen dazu, den Wasserstoffatomen innerhalb von Molekülen Elektronen zu entziehen. Wenn dies innerhalb eines Wassermoleküls geschieht, erzeugt der Elektronenverlust ein Wasserstoffatom mit einer positiven Teilladung, das dann von einem negativ geladenen Sauerstoffatom in einem anderen Wassermolekül angezogen wird.
Die Wasserstoffbrückenbindungen, die sich zwischen den Wassermolekülen bilden, sorgen dafür, dass sie zusammenkleben. Dies verleiht Wasser eine hohe Siedetemperatur, da ein höherer Grad an Wärmeenergie erforderlich ist, um die intermolekularen Wasserstoffbrückenbindungen aufzubrechen. Viele lebensnotwendige organische Substanzen wie Nukleinsäuren und Proteine enthalten Wasserstoffbrückenbindungen. Obwohl diese Bindungen schwächer sind als die internen ionischen oder kovalenten Bindungen, die zwischen den Atomen in Molekülen bestehen, ist die akkumulierte Stärke von Wasserstoffbrücken in lebenden Organismen von großer Bedeutung und spielt eine wichtige Rolle bei der Aufrechterhaltung der Stabilität.