Hämoglobin ist ein komplexes Proteinmolekül, das aus vier Untereinheiten von Polypeptiden oder Globinen besteht, bei denen es sich um Aminosäureketten handelt. Diese Globin-Untereinheiten binden an Nicht-Ptorein-Hämgruppen, die ein Eisenion enthalten, das an Sauerstoff binden kann. Diese Eisenionen sind wiederum in Ringe, den Porphyrinen, eingeschlossen.
Da Hämoglobin Eisen enthält, gilt es als Metallprotein. Vier Stickstoffatome im Porphyinring arbeiten mit dem Eisenion zusammen. Wenn sich das Eisenion mit Sauerstoff verbindet, nimmt es eine tiefere rote Farbe an.
Hämoglobin hat zwei Proteine, die es ihm ermöglichen, Sauerstoff zu transportieren und freizusetzen. Bei Erwachsenen handelt es sich um Alpha-Globin und Beta-Globin, aber während der Schwangerschaft wirkt Gamma-Globin anstelle von Beta-Globin im fetalen Hämoglobin.
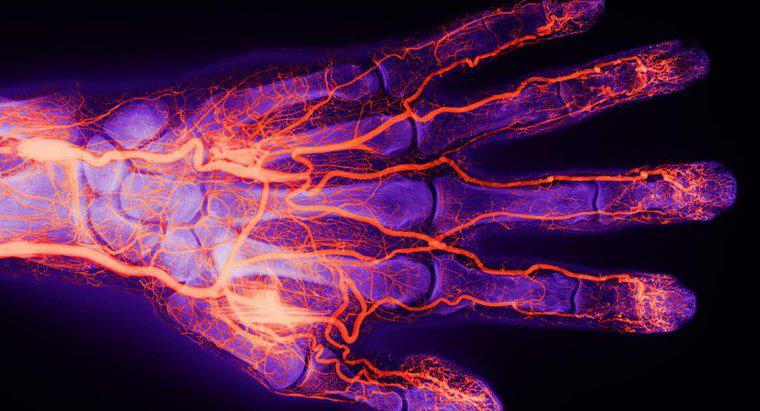
Wenn rote Blutkörperchen in die Alveolen gelangen, verbindet sich das darin enthaltene Hämoglobin mit Sauerstoff zu Oxyhämoglobin. Während die Blutzellen durch den Rest des Körpers zirkulieren, gibt das Hämoglobin den Sauerstoff an das Gewebe ab. Der Globinanteil des Hämoglobins nimmt Kohlendioxid, einen Abfallstoff, auf und gibt ihn wieder in die Alveolen ab. Hämoglobin kann gleichzeitig Sauerstoff und Kohlendioxid transportieren.
Rote Blutkörperchen bestehen fast ausschließlich aus Hämoglobin, aber Hämoglobin kommt auch in Neuronen, Alveolen und weißen Blutkörperchen, den sogenannten Makrophagen, vor.