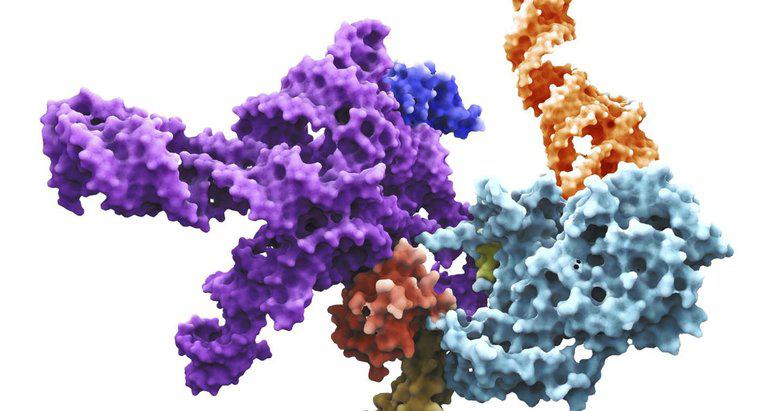
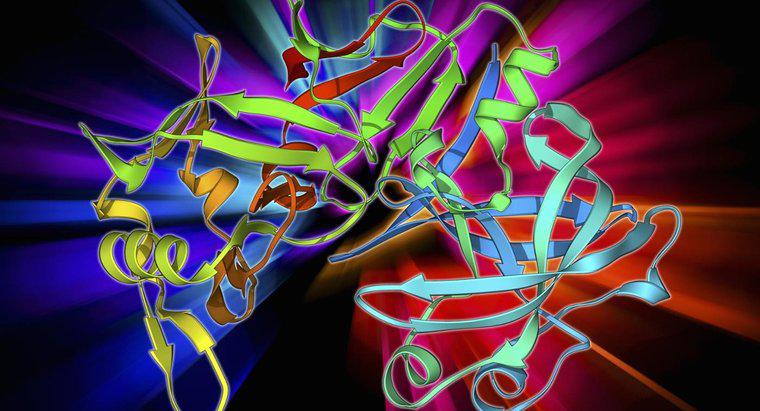
Eine allosterische Regulation ist die biochemische Regulation eines Enzyms oder Proteins durch die Bindung eines Effektormoleküls an die inaktive oder allosterische Stelle des Proteins. Diese Effektormoleküle können die Aktivität des Proteins verstärken oder hemmen und eine Konformationsänderung im Protein erzeugen.
Die durch allosterische Inhibitoren verursachte Konformationsänderung verändert die Größe und Form des aktiven Zentrums, sodass das Molekül, auf das das Enzym einwirkt, nicht daran binden kann. Allosterische Aktivatoren verändern das aktive Zentrum, um die Affinität des Substrats für das Enzym zu erhöhen. Allosterische Zentren werden derzeit verwendet, um sicherere Medikamente zur Behandlung einer Vielzahl von Krankheiten zu entwickeln, einschließlich hämolytischer Anämie und Schizophrenie.