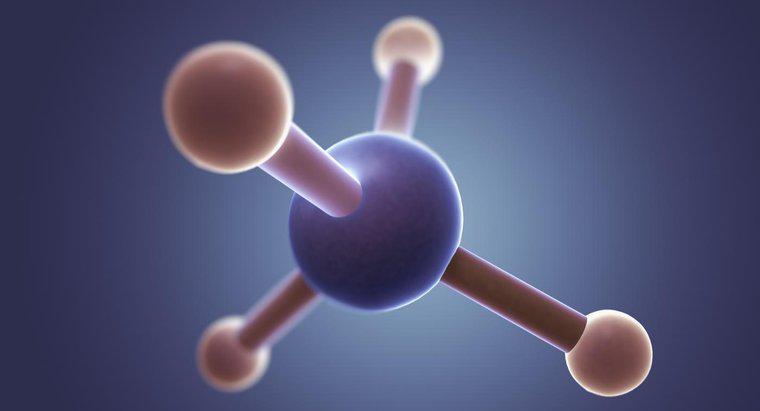
Die Lewis-Struktur von CS2 besteht aus einem einzelnen Kohlenstoffatom mit einem Schwefelatom auf jeder Seite. Die Bindungen in der Lewis-Struktur sind entweder eine Doppelbindung, die das Kohlenstoffatom mit jedem Schwefelatom verbindet, oder ein Schwefelatom, das mit einer Dreifachbindung und das andere mit einer Einfachbindung verbunden ist.
Lewis-Strukturen für Moleküle werden normalerweise durch Versuch und Irrtum geschrieben, es sei denn, sie sind bereits bekannt. Die Methode zum Ermitteln einer Lewis-Struktur erfordert, dass alle Valenzelektronen berücksichtigt werden und alle Atome in der Struktur mit einer vollständigen Hülle aus Valenzelektronen enden.
Verbinde zuerst alle Atome mithilfe der Elektronegativität der Elemente, um zu bestimmen, welche Atome wohin gehören. Wenn Sie ein Kohlenstoffatom und mehrere andere Atome haben, befindet sich das Kohlenstoffatom normalerweise in der Mitte. Im Fall von CS2 ist das Kohlenstoffatom weniger elektronegativ und bildet das Zentrum.
Bestimmen Sie als Nächstes, wie viele Elektronen vorhanden sind. In CS2 tragen die Schwefelatome jeweils sechs Valenzelektronen und das Kohlenstoffatom vier bei, also insgesamt sechzehn. Um alle drei Atome mit einer vollen Valenzschale von 8 Elektronen zu versehen, wären 24 Elektronen nötig. Das bedeutet, dass das CS2-Molekül insgesamt 8 Bindungen aufweisen muss, die die drei Atome verbinden.