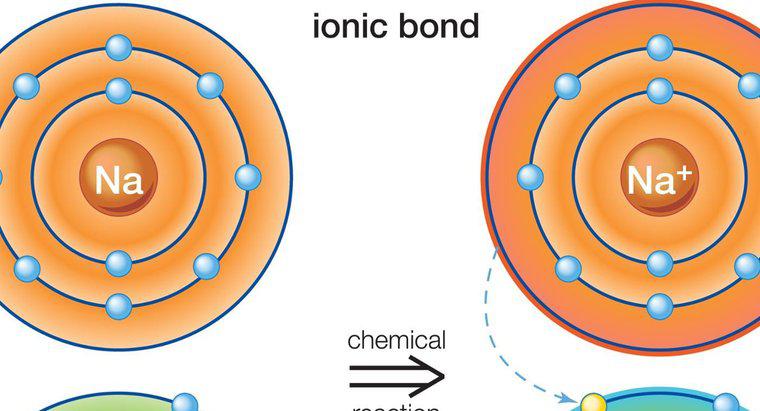
Die an der Ionenbindung beteiligten Atome werden durch eine elektrostatische Anziehungskraft zwischen einem positiven und einem negativen Ion zusammengehalten. Ionenbindungen werden nur zwischen Metallen und Nichtmetallen gebildet.
Ionenbindung tritt in Gegenwart eines positiven und eines negativen Ions auf. Ionen entstehen, wenn neutrale Atome entweder ein Elektron verlieren oder aufnehmen. Alle Atome verlieren oder gewinnen Elektronen, um eine stabile Elektronenkonfiguration zu erreichen. Die stabilsten Edelgase haben alle acht Elektronen in ihrer äußersten Schale, mit Ausnahme von Helium, das nur zwei Elektronen hat. Wenn ein Atom acht Elektronen in seiner äußeren Hülle hat, spricht man von einer stabilen Oktettstruktur.
Metalle haben ein bis drei Elektronen in ihrer äußeren Hülle, was verhindert, dass sie eine stabile Oktettstruktur bilden. Es ist einfacher für die Atome, Elektronen zu verlieren, um eine darunterliegende Schale mit acht Elektronen freizulegen, anstatt Elektronen zu gewinnen, um die Oktettstruktur zu vervollständigen. Daher bilden Metalle positive Ionen. Nichtmetalle neigen jedoch dazu, ein oder mehrere Elektronen aufzunehmen, um das Oktett in ihrer äußersten Schale zu vervollständigen, und neigen daher dazu, negative Ionen zu bilden.
Metalle können ihre Elektronen an Nichtmetalle abgeben. Da die Ladungen der Ionen unterschiedlich sind (entgegengesetzt geladene Ionen), wird das positiv geladene Metallatom mit einer starken elektrostatischen Anziehungskraft an das negativ geladene Nichtmetallatom gehalten.