Bei einer ionischen Bindung verlässt ein Elektron ein Atom, um sich einem anderen zu verbinden, während eine kovalente Bindung die gemeinsame Nutzung von Elektronen zwischen zwei Atomen ist. Polare kovalente Bindungen treten auf, wenn zwei Atome eine ungerade Anzahl von Elektronen teilen .
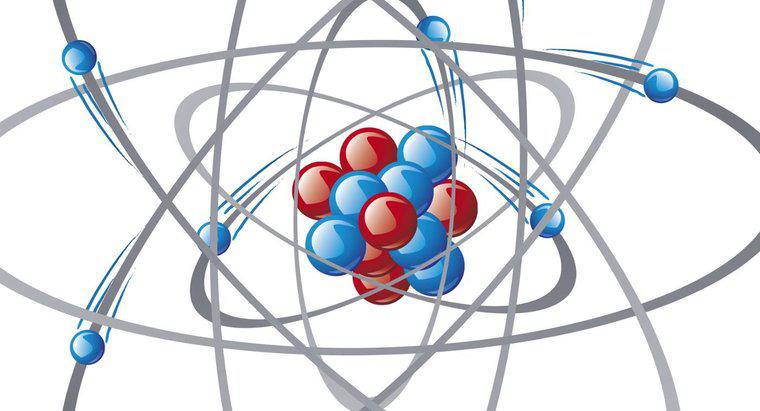
Chemische Bindungen bilden sich aufgrund von Wechselwirkungen zwischen Valenzelektronen in Atomen. Valenzelektronen besetzen die äußerste Hülle oder das Energieniveau eines Atoms. Ist die Valenzschale mit möglichst vielen Elektronen gefüllt, handelt es sich um eine geschlossene Schale. Atome mit geschlossenen Schalen neigen dazu, inert zu sein und reagieren kaum mit anderen Atomen und Molekülen. Atome mit offenen Valenzschalen werden wahrscheinlich Elektronen aufnehmen, abgeben oder teilen, um eine geschlossene Schale zu bilden.
Ionenbindungen beinhalten die vollständige Übertragung von Elektronen von einem Atom zum anderen und erfordern einen Donor und einen Empfänger. Atome mit wenigen Elektronen in der äußersten Schale spenden am ehesten, während Atome mit vielen Valenzelektronen oft mehr aufnehmen, um eine geschlossene Schale zu bilden. Ionenbindung führt zur Bildung von zwei geladenen Atomen oder Ionen. Ein Beispiel ist Salz oder Natriumchlorid. Natriumatome geben leicht Elektronen ab, was zu einer positiven Ladung führt. Chloratome nehmen diese Elektronen auf und werden negativ geladen. Die beiden entgegengesetzt geladenen Atome ziehen sich dann gegenseitig an und bilden ein Natriumchlorid-Molekül.
Einige Atome teilen sich Elektronen, um eine geschlossene Schale zu erhalten; dies wird als kovalente Bindung bezeichnet. Sauerstoffatome benötigen beispielsweise zwei zusätzliche Elektronen, um eine geschlossene Schale zu bilden, während Wasserstoffatome eines benötigen. Ein Sauerstoffatom teilt leicht zwei seiner Elektronen mit Wasserstoffatomen, sodass alle drei Atome geschlossene Schalen haben. Durch die Anordnung entsteht ein Wassermolekül. Sauerstoff übt jedoch eine stärkere Anziehungskraft auf die Elektronen aus als Wasserstoff; Daher verbringen die geteilten Elektronen mehr Zeit um das Sauerstoffatom herum als um die Wasserstoffatome. Das Sauerstoffatom trägt dann eine negative Teilladung, und die Wasserstoffatome tragen jeweils eine positive Teilladung. Die Bindung, die zu dieser ungleichen Ladung führt, wird als polare kovalente Bindung bezeichnet.