Ionische Verbindungen leiten Elektrizität, wenn sie in Wasser gelöst werden, weil die Bewegung ihrer negativ geladenen und positiv geladenen Partikel einen elektrischen Strom erzeugt, erklärt About.com. In diesem flüssigen Zustand trennen sich die geladenen Ionen und sich frei bewegen, wodurch ein Strom aus elektrischen Teilchen entsteht, der Elektrizität leitet.
Elektrische Leitfähigkeit misst die Fähigkeit einer Substanz, elektrischen Strom zu erzeugen, während Elektrizität die Bewegung geladener Teilchen ist, die diesen elektrischen Strom bilden. Ein Strom ist im elektrischen Bereich einfach ein Ladungsfluss, der freie Bewegung erfordert. Damit sich der elektrische Strom bilden kann, müssen sowohl Bewegung als auch Leitfähigkeit vorhanden sein.
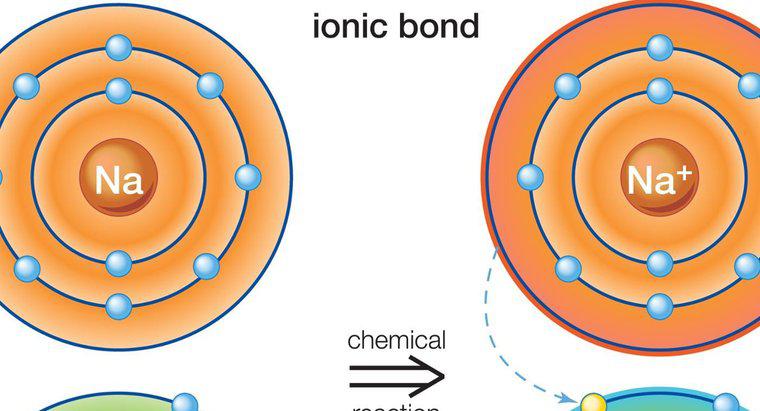
Ionische Verbindungen entstehen, wenn positiv und negativ geladene Ionen eng miteinander verbunden sind. Diese Ionen sind Atome, die ein Elektron gewonnen oder verloren haben, und sie kommen zusammen, indem sie ein Elektron in einem Prozess namens Ionenbindung übertragen. Ein positiv geladenes Ion ist ein Kation, während ein negativ geladenes Ion ein Anion ist. Ein Beispiel für eine ionische Verbindung ist Natriumchlorid, NaCl, wobei Natrium (NA) das Kation und Chlor (Cl) das Anion ist.
Ionische Verbindungen haben in ihrem festen Zustand Partikel, die fest zusammengehalten werden, was jegliche Bewegung einschränkt und die Bildung von elektrischem Strom verhindert. Folglich leiten ionische Feststoffe keinen Strom. Beim Auflösen in Wasser wird die Ionenbindung gebrochen, wodurch die geladenen Ionen getrennt werden und frei fließen können. Das Wasser sorgt für die Bewegung der Partikel und die abgetrennten Ionen sorgen für die Leitfähigkeit. Da beides vorhanden ist, wird ein elektrischer Strom erzeugt, um Elektrizität zu leiten.