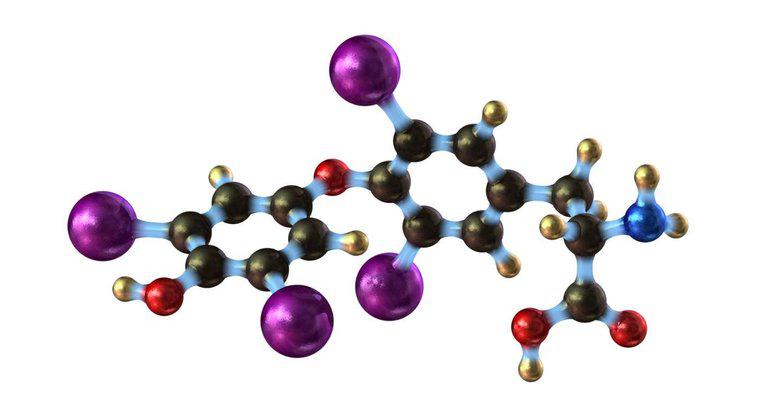
Wenn Jod erhitzt wird, werden die intermolekularen Bindungen aufgebrochen und das Jod geht direkt aus fester kristalliner Form in den Dampf über. Dies liegt daran, dass die Bindungen zu schwach sind, um unter diesen Bedingungen die flüssige Form aufrechtzuerhalten (etwas darüber). Raumtemperatur und Standardatmosphärendruck). Wenn Sie das Jod weiter erhitzen, würde es schließlich bei 113,6 °C schmelzen und bei 185 °C kochen.
Wasser wird häufig verwendet, um die drei gängigen Aggregatzustände zu veranschaulichen: fest, flüssig und gasförmig. Durch Wärmeeinwirkung werden die intermolekularen Bindungen gelöst und flüssiges Wasser gebildet. Bei noch mehr Wärmeeinwirkung lockern sich die Bindungen noch weiter und das Wasser verdampft. Der gleiche Übergang kann bei der überwiegenden Mehrheit der auf der Erde vorkommenden Substanzen beobachtet werden.
Jod folgt diesem üblichen Muster nicht, da die intermolekularen Bindungen in fester Form nicht so stark sind wie bei den meisten anderen Substanzen. Bei normalem Atmosphärendruck können sich die Jodmoleküle bei minimaler Wärmezufuhr vollständig von der festen Form lösen und werden stattdessen zu Dampf. Wenn das Jod weiter erhitzt wird, erhöht sich der Dampfdruck (die Gasmenge im Gleichgewicht mit dem festen oder flüssigen Zustand). Eine Erhöhung der Temperatur erhöht auch den Dampfdruck, bis das Jod schmilzt und dann kocht.