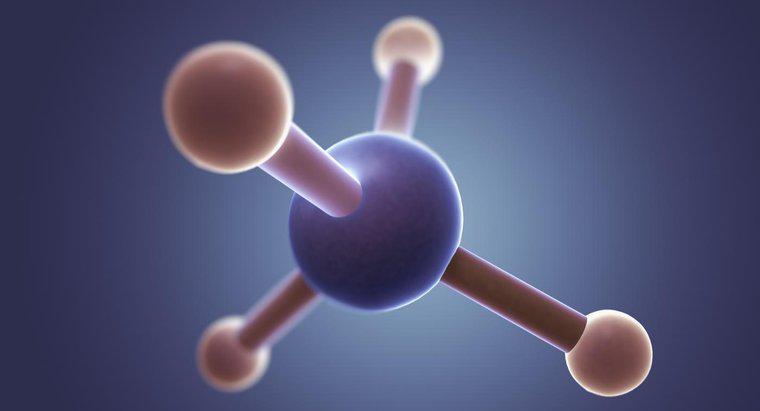
SiCl4 ist Siliziumtetrachlorid, das ein unpolares Molekül ist. Siliziumtetrachlorid ist unpolar, da die vier chemischen Bindungen zwischen Silizium und Chlor gleichmäßig verteilt sind. Die gleichmäßige Verteilung der polaren Bindungen führt zu einem Molekül, das keine unterschiedlichen Pole hat.
Siliziumtetrachlorid ist bei Raumtemperatur und normalem Atmosphärendruck flüssig, aber flüchtig genug, um Dämpfe zu erzeugen. Es ist nicht wasserlöslich und reagiert beim Mischen mit Wasser zu Siliziumdioxid und Salzsäure. Siliciumtetrachlorid ist in Benzol, Chloroform, Ether und Salzsäure löslich. Es wird am häufigsten verwendet, um elementares Silizium zu reinigen, das in Mikrochips und anderen Computeranwendungen verwendet wird.