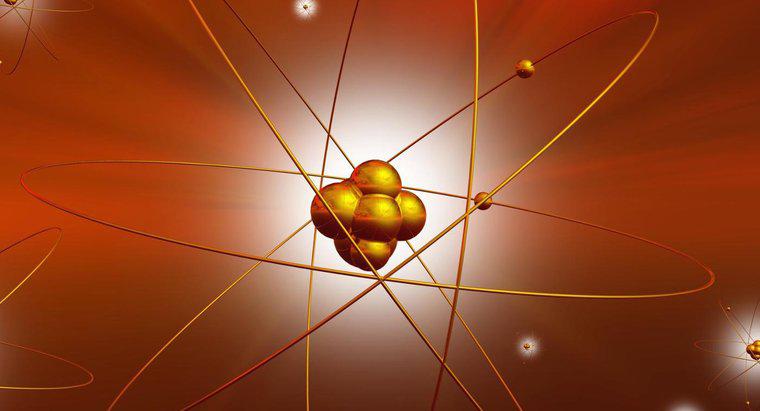
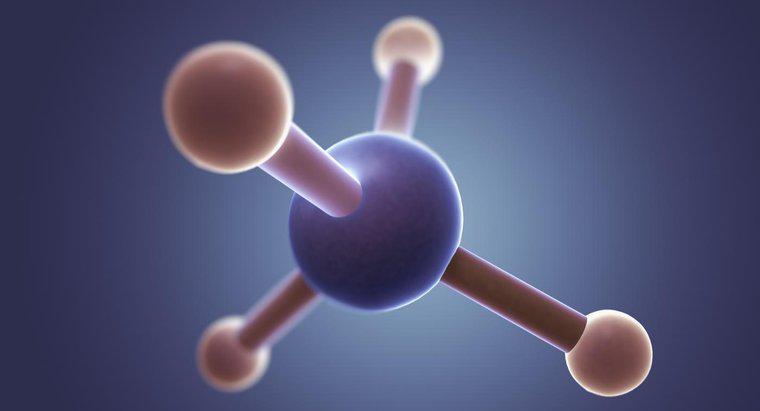
CF4 oder Tetrafluormethan ist ein tetraedrisches Molekül. Wie der "Tetra"-Teil des Namens anzeigt, hat das Molekül vier Elektronengruppen, die um ein Zentralatom gebunden sind.
Wie bei vielen Elektronenbindungen besteht ein tetraedrisches Molekül aus mehreren Teilen. Der Hauptteil des Moleküls ist das Atom, das immer im Zentrum liegt. Die vier Elektronengruppen sind um das Atom herum angeordnet. Diese Elektronen befinden sich nie in einsamen Paaren und bleiben immer in einem gleichmäßigen Muster um das Atom herum zusammen, obwohl sie nicht immer gleich weit voneinander entfernt sind.
Da Elektronen stärker von Fluor angezogen werden als von Kohlenstoff, verbringen die Elektronen im CF4-Modell mehr Zeit in der Nähe des Fluors. Die Elektronen werden durch kovalente Bindungen zusammengehalten, und diese Bindungen ziehen zum Fluor hin und vom Kohlenstoff weg. Obwohl Fluor und Kohlenstoff ungefähr gleich sind, hat das Fluor eine stärkere Anziehungskraft. Die chemische Formel CF4 spiegelt die stärkere Anziehungskraft der Elektronen auf das Fluor wider. Das Fehlen einer Zahl beim Kohlenstoff weist darauf hin, dass die Elektronen nicht zum Kohlenstoff gezogen, sondern von diesem weggedrückt werden.