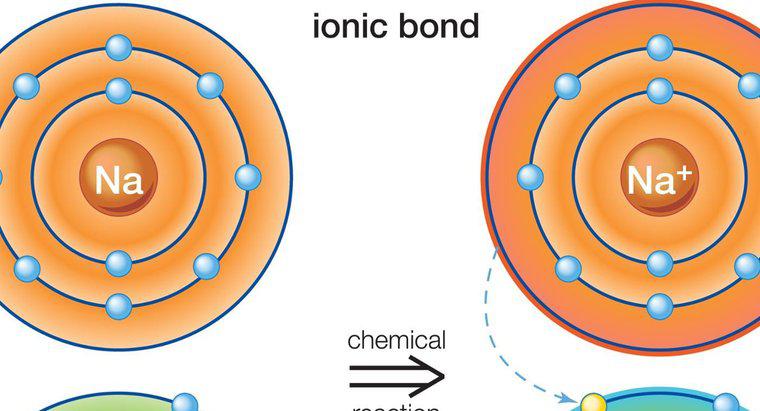
Die in Natriumchlorid gefundene Bindungsart wird als Ionenbindung bezeichnet. Die Ionenbindung ist die Anziehung zwischen zwei Atomen mit entgegengesetzter Ladung. In Natriumchlorid hat Natrium eine positive Ladung und Chlor eine negative Ladung; daher ziehen sie sich gegenseitig an und gehen eine Verbindung ein.
Natrium und Chlor sind als neutrale Atome nicht stabil. Natrium enthält ein Valenzelektron und Chlor hat sieben. Die Oktettregel besagt, dass Atome eine äußere Energiehülle wie die der Edelgase haben wollen, also acht Valenzelektronen benötigen. Diese acht Elektronen im äußersten Energieniveau stehen für Stabilität. Weder Natrium noch Chlor haben diese Edelgasstruktur, daher neigen sie dazu, Elektronen zu verlieren oder aufzunehmen, um einen stabileren Zustand zu erreichen. Natrium verliert sein einzelnes Valenzelektron an Chlor und wird zu einem Kation, einem positiv geladenen Atom. Chlor nimmt ein Elektron auf und wird zu einem Anion, einem negativ geladenen Atom. Diese beiden Ionen mit entgegengesetzten Ladungen kommen zusammen, um eine Ionenbindung zu bilden.