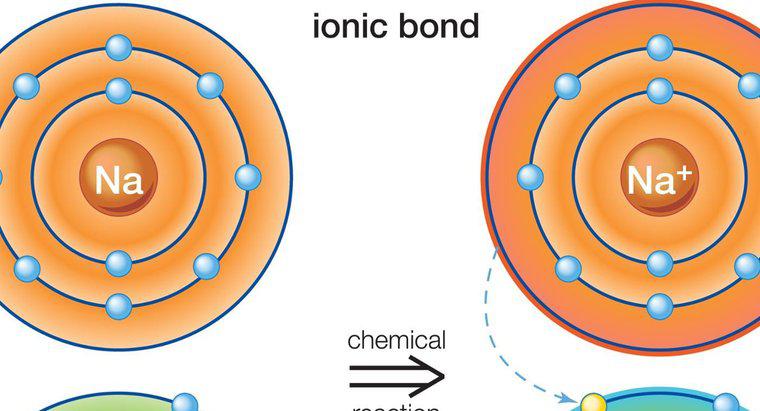
Ionische Verbindungen entstehen, wenn Elektronen von einem Atom zum anderen übertragen werden. Kovalente Verbindungen bilden sich, wenn Atome Elektronen teilen, was zu keinem Nettoverlust oder -gewinn von Elektronen wie bei ionischen Verbindungen führt.
Wenn sich zwei oder mehr verschiedene chemische Elemente verbinden, bilden sie eine Verbindung. Wie sich diese Atome verbinden oder miteinander verbinden, hängt vom Element und seinen Eigenschaften ab. Die Bindung, die die Atome zusammenhält, bestimmt die Art der Verbindung, und diese können entweder ionisch oder kovalent sein.
Grundlagen des Klebens Atome werden klassifiziert und charakterisiert durch die Anzahl der Elektronen, die sie enthalten. Jedes Element hat eine andere Anzahl von Elektronen, die in den Orbitalen untergebracht sind, die den Kern umkreisen. Das äußere Orbital wird als Valenzorbital bezeichnet und diese Elektronen werden beim Bindungsprozess verwendet. Jedes Atom strebt danach, ein vollständiges äußeres Elektronenorbital zu haben, um stabil zu sein. Für die meisten Atome enthält dieses äußere Orbital acht Elektronen. Die Oktettregel bezieht sich auf das Erfordernis von Elektronen, Elektronen zu gewinnen, zu verlieren oder zu teilen, um das äußere Orbital zu füllen. Wenn Atome Elektronen aufnehmen oder an ein anderes Element abgeben, bilden sie ionische Verbindungen. Wenn Atome Elektronen mit einem anderen Element teilen, bilden sie kovalente Verbindungen.
Ionische Verbindungen
Zwischen Metallen und Nichtmetallen bilden sich ionische Verbindungen. Metalle haben typischerweise wenige Valenzelektronen im äußeren Orbital, während Nichtmetalle viele haben. Das Metall wirkt als Donor und überträgt seine Valenzelektronen auf das Nichtmetall und erfüllt so die Oktettregel, die für die Bildung eines stabilen Atoms erforderlich ist. Dies führt zu einem positiv geladenen Metallatom und einem negativ geladenen Nichtmetallatom, den sogenannten Ionen. Aufgrund der gegensätzlichen Ladungen werden die beiden Ionen voneinander angezogen und bleiben eng beieinander, wodurch eine ionische Verbindung entsteht. Dabei kann mehr als ein Elektron übertragen werden. Da die geladenen Atome frei schweben, werden sie von anderen Atomen mit der entgegengesetzten Ladung angezogen, nicht nur von dem einzelnen Atom, von dem sie Elektronen abgegeben oder von dem sie Elektronen erhalten haben.
Die Eigenschaften ionischer Verbindungen sind, dass es sich um kristalline Feststoffe mit hohen Schmelz- und Siedepunkten handelt. Sie leiten beim Schmelzen Strom und sind in Wasser löslich, jedoch nicht in unpolaren Flüssigkeiten. Eine der häufigsten ionischen Verbindungen ist Natriumchlorid (NaCl), auch als Kochsalz bekannt.
Kovalente Verbindungen
Im Gegensatz dazu treten kovalente Verbindungen typischerweise zwischen Nichtmetallen oder zwei Atomen desselben oder ähnlicher Elemente auf. Atome mit ähnlichen Elektronegativitäten, die aus dem Periodensystem bestimmt werden können, neigen dazu, sich gegenseitig anzuziehen und kovalente Bindungen einzugehen. Anstatt die Valenzelektronen vollständig zu übertragen, teilen sich die Atome die äußeren Elektronen, um die Oktettregel zu erfüllen. Die gemeinsamen Elektronen können sich zwischen den gebundenen Atomen hin und her bewegen. Bei dieser Bindungsart nimmt kein Atom ein Elektron auf oder verliert es, so dass keine Ionen gebildet werden. Aus diesem Grund werden die Atome in der Verbindung nicht von anderen Atomen in der Nähe angezogen, wie dies bei ionischen Verbindungen der Fall ist.
Kovalente Verbindungen können Feststoffe, Flüssigkeiten oder Gase sein. Sie neigen dazu, schlechte elektrische Leiter zu sein und haben niedrige Schmelz- und Siedepunkte. Sie neigen dazu, in unpolaren Flüssigkeiten löslich zu sein, aber nicht in Wasser. Einige gängige Beispiele für kovalente Verbindungen sind Methan (CH4) und Kohlendioxid (CO2).