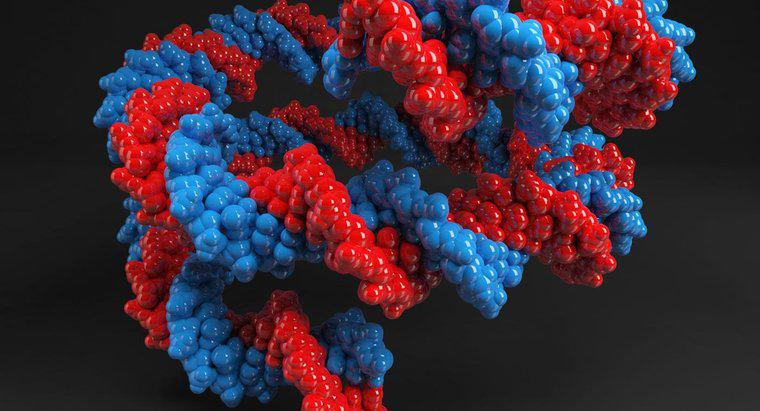
Proteine haben komplexe Strukturen, die von den Seitenketten ihrer Aminosäuren bestimmt werden. Die Natur der Seitenketten kann sich ändern, wenn sich der pH-Wert ihrer Umgebung ändert, was die gesamte Proteinstruktur beeinflussen und inaktiv machen könnte.
Alle Enzyme sind Proteine und ihre Funktion hängt von der Struktur des Enzyms ab. Die Struktur eines Proteins wird durch drei Ebenen bestimmt. Die Primärstruktur bezieht sich auf die Aminosäuresequenz. Die Sekundärstruktur umfasst die lokalen Falten, die Alpha-Helices oder Beta-Faltblätter bilden. Die Tertiärstruktur wird durch Kombinieren der Sekundärstrukturen gebildet. Die Sekundär- und Tertiärstrukturen werden durch Bindungen zwischen den Seitenketten der Aminosäuren gebildet. Enzyme haben eine spezifische Stelle, die als aktive Stelle bezeichnet wird und an das Substrat bindet, mit dem sie reagieren, um eine physiologische Veränderung in der Zelle herbeizuführen. Wenn sich die Struktur des aktiven Zentrums ändert, könnte das Enzym inaktiviert werden. Eine Änderung des pH-Werts der Umgebung des Enzyms könnte die Natur der Seitenketten des Enzyms und die von ihnen gebildeten Bindungen verändern. Dies führt zu einer anderen Struktur als die aktive Form des Enzyms. Die meisten Enzyme und Proteine neigen dazu, bei neutralem pH zu funktionieren. Es gibt einige Enzyme, die bei einem niedrigeren pH-Wert funktionieren, wie sie beispielsweise im Magen vorkommen. In solchen Fällen werden sie durch Änderung des pH-Werts auf einen neutralen pH-Wert inaktiviert.