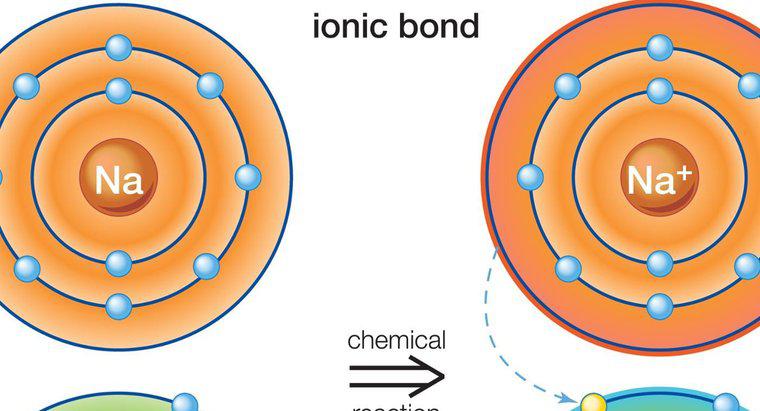
Größere Atome mit komplexen Elektronenorbitalen, wie sie in Übergangsmetallen vorkommen, können unter den richtigen Bedingungen die Oktettregel überschreiten. Diese treten insbesondere auf, wenn die schwereren Elemente an . gebunden sind kleine, stark elektronegative Elemente wie Fluor, Chlor oder Sauerstoff. Ein Beispiel ist Phosphorpentachlorid, ein einzelnes Phosphoratom, das an fünf Chloratome gebunden ist und in seiner äußeren Valenzschale 10 gemeinsame Elektronen hat.
Wenn ein Element eine ausreichend hohe Ordnungszahl hat, steht ein neuer Typ von Elektronenorbitalen mit einer Kapazität von bis zu 10 Elektronen zur Verfügung, die bis zu fünf Einfachbindungen ermöglichen. Dies ist bei Phosphorpentachlorid der Fall. Um dieses Orbital zu nutzen, muss die Reaktion, die die Verbindung erzeugt, die dieses Orbital verwendet, jedoch energetisch sehr günstig sein. Damit es funktioniert, müssen daher Elemente mit einer sehr starken Fähigkeit, Elektronen anzuziehen und zu binden, auch Elektronegativität genannt, beteiligt sein. Sauerstoff hat eine hohe Elektronegativität, aber es ist unwahrscheinlich, dass er eine Verbindung mit fünf gebundenen Atomen wie Chlor erzeugt, da er zwei Elektronen benötigt, um seine äußere Valenzschale zu vervollständigen. Fluor und Chlor benötigen jeweils nur eine, was diese Art von Konfiguration wahrscheinlicher macht.