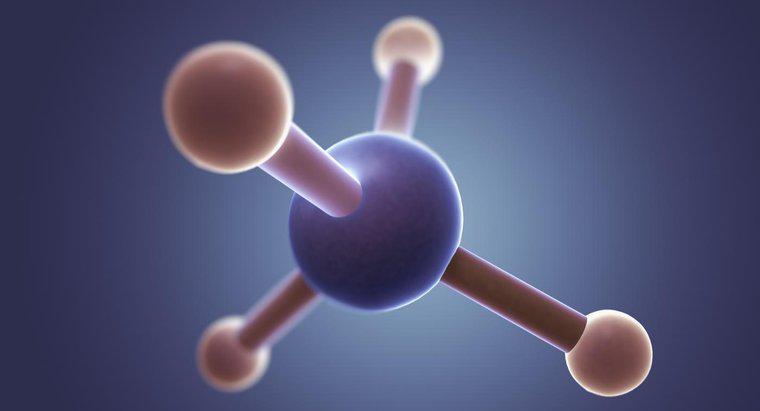
Die Struktur des Methanmoleküls CH4 weist einfache kovalente Bindungen auf. Bei kovalenten Bindungen werden Elektronen gemeinsam genutzt. Im Methanmolekül teilen sich die vier Wasserstoffatome jeweils ein Elektron mit dem Kohlenstoffatom.
Einige Eigenschaften kovalenter Bindungen sind, dass sie dazu neigen, zwischen zwei Nichtmetallatomen aufzutreten, niedrige Siede- und Schmelzpunkte und eine niedrige Polarität haben. Bei Raumtemperatur sind diese kovalenten Moleküle entweder gasförmig oder flüssig. Methan ist beispielsweise ein Gas.
Im Gegensatz dazu sind ionische Bindungen eher in festen Verbindungen vorhanden. Ionenbindungen treten zwischen einem Metall und einem Nichtmetall auf. Einige Eigenschaften von ionischen Bindungen in Verbindungen sind, dass sie hohe Schmelz- und Siedepunkte aufweisen.