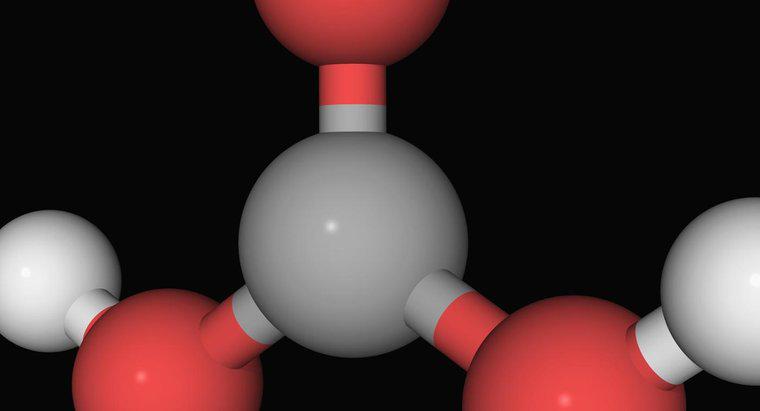
Ammoniak, eine gasförmige Verbindung aus einem Stickstoffatom, das an drei Wasserstoffatome gebunden ist, ist keine starke Base. Es ist eine schwächere Base, die im Allgemeinen mit Wasser reagieren muss, bevor sie mit einer Säure reagiert. Bevor es Säuren in einer Lösung neutralisiert, reagiert es mit Wasser zu Ammonium- und Hydroxidionen. Ammonium ist ein positives Ion aus einem Stickstoff- und vier Wasserstoffatomen und eine schwache Säure.
Alle Basen funktionieren, indem sie Wasserstoffionen aufnehmen, die nur nackte Protonen sind. Dies neutralisiert Säuren, da Säuren durch die Freisetzung von Wasserstoffionen mit anderen Materialien reagieren. Basen reagieren mit diesen Ionen stärker als andere Materialien und können diese anderen Materialien vor den Säuren schützen. Basen selbst können jedoch korrosiv sein.
Die stärksten Basen, wie Natriumhydroxid, funktionieren, indem sie ihre Hydroxidionen in Lösung dissoziieren. Die Hydroxidionen reagieren sehr stark mit Wasserstoffionen zu Wasser. Die anderen Komponenten der Säuren und Basen assoziieren oft als Salze. Ammoniak enthält jedoch keine Hydroxidionen. Es muss zuerst mit Wasser reagieren, um sie zu erzeugen. Dies fügt nicht nur einen Schritt vor der Neutralisierung von Säuren hinzu, es wird auch teilweise durch die Bildung von Ammonium, einer schwächeren Säure, entgegengewirkt.