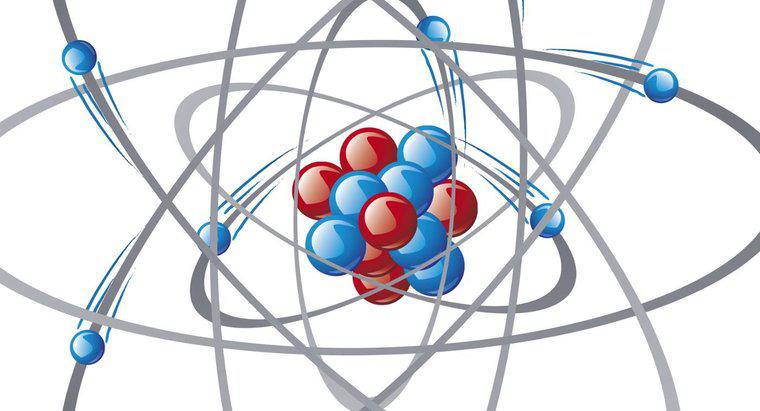
Kationen sind positiv geladene Ionen und Anionen sind negativ geladene Ionen. Metalle wirken als Kationen und geben bereitwillig Elektronen ab oder geben sie an Nichtmetalle ab. Nichtmetalle wirken als Anionen und nehmen abgegebene Elektronen auf. Atome sind am stabilsten, wenn ihre äußerste Schale acht Elektronen enthält. Dazu reagieren Metalle und Nichtmetalle miteinander und bilden ionische Bindungen. Diese positive und negative Anziehung ist es, die ionische Verbindungen erzeugt, erklärt Dummies.com
Für jedes Elektron, das ein Kation abgibt, erhält es eine positive oder 1+ Ladung. Für jedes Elektron, das ein Anion aufnimmt, erhält es eine negative oder 1-Ladung. Die Menge an Elektronen, die ein Atom abzugeben oder aufzunehmen bereit ist, kann oft durch die Position des Elements im Periodensystem bestimmt werden. Gruppe 1A enthält Alkalimetalle, die ein einzelnes Elektron für eine 1+-Ladung abgeben. Die Erdalkalimetalle der Gruppe 2A verlieren bei einer Ladung von 2+ zwei Elektronen. Aluminium verliert bei einer Ladung von 3+ drei Elektronen. Die Bestimmung der Übergangsmetalle oder B-Familienmitglieder des Periodensystems kann schwieriger sein. Viele dieser Elemente können unterschiedlich viele Elektronen verlieren, sodass sie zwei oder mehr Kationenvarianten bilden können.
Die Anzahl der Elektronen, die ein Nichtmetall oder Anion aufnehmen möchte, hängt von der Anzahl der Valenzelektronen ab. Valenzelektronen sind diejenigen in der äußersten Schale des Atoms, und Atome sind mit insgesamt acht Valenzelektronen am stabilsten. Dazu nehmen sie das von Kationen abgegebene Elektron auf. Die Halogene der Gruppe 7A des Periodensystems haben sieben Valenzelektronen. Sie nehmen ein Elektron für eine 1-Ladung auf. Anionen der Gruppe 6A nehmen zwei Elektronen für eine 2-Ladung auf. Elemente der Gruppe 5A nehmen drei Elektronen für eine 3-Ladung auf. Elemente der Gruppe 8A sind Edelgase und haben bereits vollwertige Elektronenschalen und sind daher nicht reaktiv.