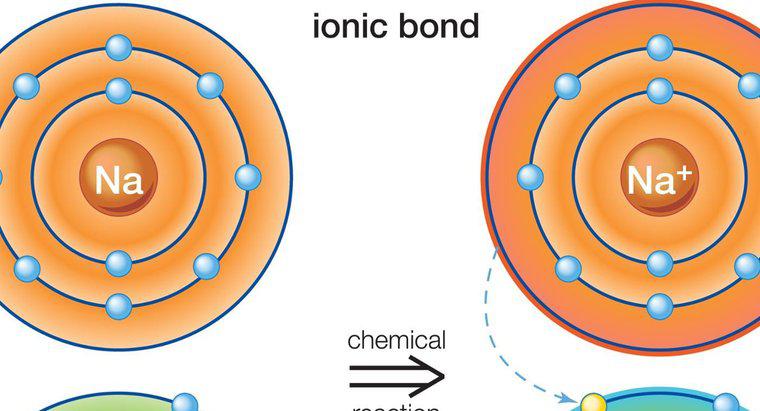
Eine ionische Bindung ist eine Art chemischer Bindung, die zwischen zwei Atomen durch die Übertragung der Valenzelektronen von einem Atom auf ein anderes hergestellt wird. Diese Art von Bindung wird auch als elektrovalente oder polare Bindung bezeichnet. Salze sind ein gutes Beispiel für Substanzen, die mit Ionenbindung hergestellt werden.
Eine ionische Bindung umfasst ein Metall- und ein Nichtmetallatom. Jedes Atom hat die Tendenz, die stabile Elektronenkonfiguration zu erreichen, das heißt, die Oktettzahl (2 oder 8) seiner Valenzschale zu erreichen. Das Metallatom hat in seiner Valenzschale einen Elektronenüberschuss oberhalb der Oktettzahl. Andererseits ist das Nichtmetallatom elektronenarm und benötigt daher Elektronen, um sein Oktett zu erfüllen. Kommen sie zueinander, gibt das Metallatom seine überschüssigen Elektronen an das Nichtmetallatom ab. Als Ergebnis dieses Elektronentransfers erreicht jedes der Atome die stabile Elektronenkonfiguration. Die Verbindung wird durch diese Bindung gebildet, die als ionische oder elektrovalente Verbindung bezeichnet wird. Bei ionischen Bindungen muss die Nettoladung der Verbindung null sein. Einige Beispiele für ionische Verbindungen sind: NaCl (Natriumchlorid), MgO (Magnesiumoxid), CaF2 (Calciumfluorid) und Al2O2 (Aluminiumoxid). In der realen Welt sind Verbindungen mit reinen Ionenbindungen nicht bekannt. Alle ionischen Verbindungen haben einen gewissen Grad an kovalenter Bindung.