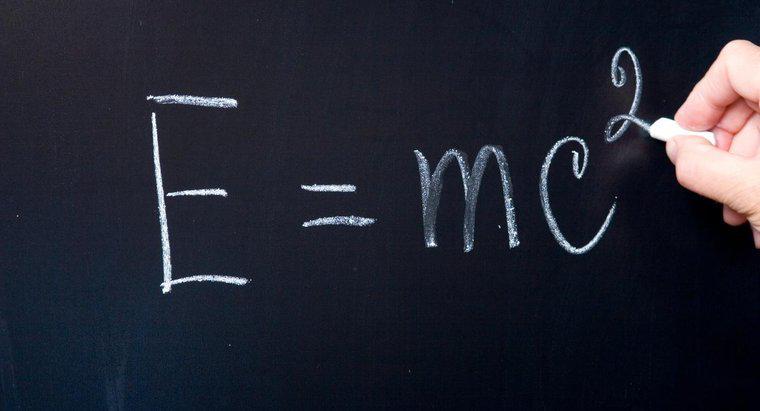Ein einzelnes Neutron hat eine Masse von 1.008665 atomaren Masseneinheiten. Eine atomare Masseneinheit ist eine sehr kleine Masseneinheit, die einem Zwölftel der Masse eines Kohlenstoff-12-Atoms entspricht. Neutronen haben eine etwas größere Masse als Protonen, die eine Masse von 1.007277 atomaren Masseneinheiten haben.
Die Masse von Neutronen und Protonen kann verwendet werden, um die Atommasse eines Atoms zu berechnen, die gleich der kombinierten Masse der Neutronen und Protonen in seinem Kern ist. Die Atommasse, die in atomaren Masseneinheiten ausgedrückt wird, kann berechnet werden, indem die Anzahl der Neutronen mit 1.008665 und die Anzahl der Protonen mit 1.007277 multipliziert und dann diese beiden Produkte addiert werden.
Neutronen sind Atomteilchen, die eine neutrale Ladung tragen und sich in den Kernen von Atomen befinden. Atome eines Elements, die unterschiedlich viele Neutronen enthalten, werden Isotope genannt. Die durchschnittliche Atommasse eines Elements wird berechnet, indem die Masse jedes Isotops mit seiner relativen Häufigkeit in der Natur multipliziert und dann diese Produkte addiert werden. Im Allgemeinen ist die für jedes Element des Periodensystems angezeigte Atommasse die durchschnittliche Masse aller seiner natürlichen Isotope. Manchmal wird die Atommasse auf die nächste ganze Zahl gerundet; diese Zahl ist als Massenzahl eines Elements bekannt.