Die Form eines Proteins wird durch die vier Ebenen der Proteinstruktur bestimmt: primär, sekundär, tertiär und quaternär. Andere Chaperon-Proteine sind in der Zelle vorhanden und sorgen dafür, dass sich ein Protein in seine . faltet richtige Form.
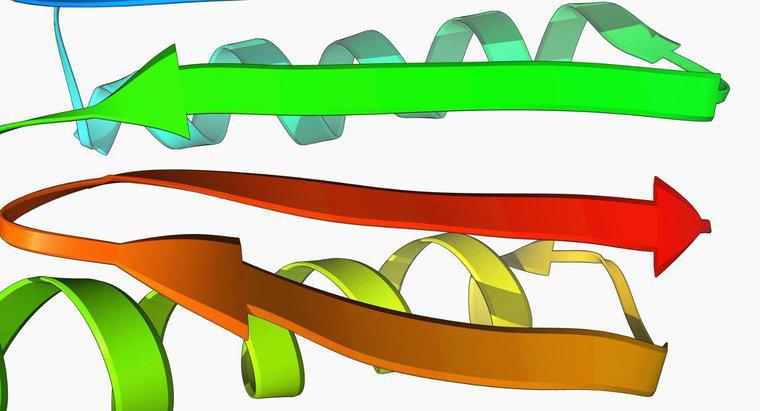
Proteine bestehen aus Polypeptiden, in denen eine Sequenz von Aminosäuren durch Peptidbindungen verbunden ist. Diese Sequenz wird als Primärstruktur eines Proteins bezeichnet. Die Primärstruktur wird am häufigsten durch Ein-Buchstaben- oder Drei-Buchstaben-Abkürzungen für die Aminosäuren angegeben, beginnend mit der N-terminalen Seite. Sekundärstruktur ist ein regelmäßig gefalteter Abschnitt eines Proteins, der durch Wasserstoffbrücken zwischen den Rückgratatomen der Aminosäuren gebildet wird. Die beiden Haupttypen der Sekundärstruktur sind Alpha-Helices und Beta-Sheets. Eine Alpha-Helix enthält 3,6 Aminosäuren pro Helixwindung. Die Aminosäure Prolin passt aufgrund ihrer starren Struktur nicht in eine Helix. Beta-Faltblätter enthalten Ketten von Peptidbindungen, die sich nebeneinander aufreihen. Sie können entweder parallel sein, bei dem sich beide Stränge direktional ausrichten, oder antiparallel, bei dem jedes Blatt entgegengesetzt gerichtet ist.
Tertiärstruktur ist die dreidimensionale Struktur der gesamten Peptidkette. In Proteindiagrammen werden Alpha-Helices im Allgemeinen als Spulen und Beta-Faltblätter als flaches Band dargestellt. Die Tertiärstruktur wird durch die Wechselwirkungen der Seitenketten einer Aminosäure, wie durch ihre Eigenschaften bestimmt, aufrechterhalten. Eine Quartärstruktur liegt in Proteinen vor, die mehr als eine Polypeptidkette enthalten, die als Domäne bezeichnet wird. Es ist die räumliche Anordnung der Domänen.