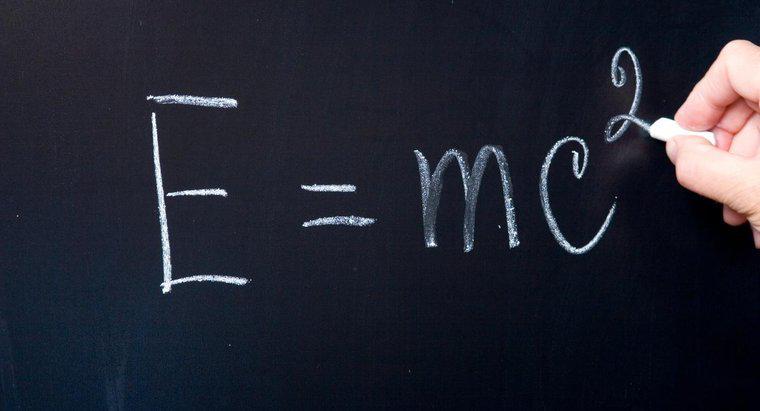Das "höchste besetzte Energieniveau" bezeichnet das Energieniveau, in dem sich die Valenzelektronen befinden. Elemente folgen der Oktettregel, was bedeutet, dass sie die stabile Anordnung mit acht Elektronen in ihrem höchsten besetzten Bereich erreichen wollen Energielevel. Einige Atome wollen Elektronen abgeben, andere wollen Elektronen aufnehmen, um stabiler zu werden.
Valenzelektronen existieren nur in den s- und p-Orbitalen des höchsten Energieniveaus. Das Aufbauprinzip besagt, dass Elektronen zuerst die niedrigsten Energieniveaus füllen müssen, bevor sie sich zum nächsten Energieniveau bewegen. Jedes Energieniveau hat eine bestimmte Anzahl von Orbitalen; nur zwei gegenläufige Elektronen können jedes Orbital füllen. Elektronen existieren in unterschiedlichen Abständen vom Atomkern. Elektronen, die näher am Kern Orbitale besetzen, haben eine niedrigere Energie als diejenigen, die weiter entfernt kreisen.
Die stabilsten Elemente des Periodensystems, die Edelgase, haben acht Elektronen in ihrem höchsten besetzten Energieniveau; die Edelgase gehen mit anderen Elementen nicht leicht Verbindungen ein. Die Elektronen im höchsten besetzten Energieniveau haben viel mit der Reaktivität des Elements zu tun. Elemente wie die Metalle mit wenigen Elektronen in ihren höchsten Energieniveaus wollen diese an andere Elemente abgeben. Elemente wie die Nichtmetalle haben in ihren äußersten Energieniveaus fast eine vollständige Anzahl von acht Elektronen, also wollen sie Elektronen aus Elementen gewinnen.