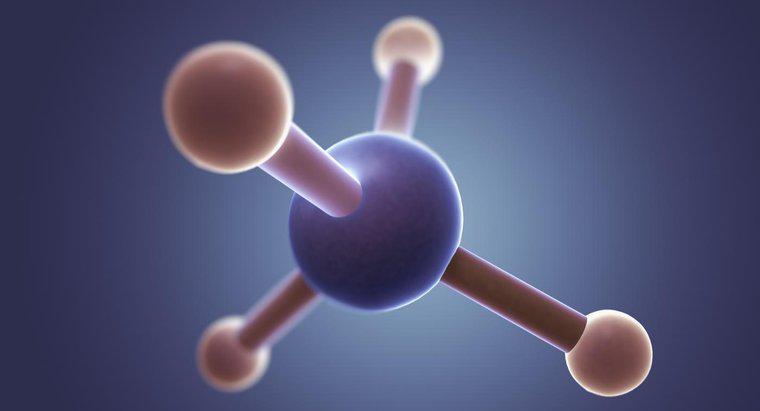
Methylchlorid (CH3Cl) hat eine tetraedrische Form mit einem Bindungswinkel von 109,5 Grad. Dies liegt daran, dass Kohlenstoff vier Valenzelektronen hat, die vier Bindungen bilden, und in einem dreidimensionalen Raum ermöglicht eine tetraedrische Form, dass die gebundenen Elektronen am weitesten voneinander entfernt sind.
Molekülformen werden mithilfe der Valenzschalen-Elektronenpaar-Abstoßungstheorie (VSEPR) vorhergesagt. Laut VSEPR haben Moleküle eine geometrische Form, die es ihren negativen Ladungszentren (gebundene und einsame Elektronenpaare) ermöglicht, aufgrund der gegenseitigen Abstoßung der negativen Ladungen so weit wie möglich voneinander entfernt zu sein. Moleküle mit zwei negativen Zentren neigen dazu, linear zu sein (ein Bindungswinkel von 180 Grad in einer zweidimensionalen Ebene). Moleküle mit drei negativen Zentren sind trigonal-planar (Bindungswinkel von 120 Grad in einer zweidimensionalen Ebene) und Moleküle mit vier negativen Zentren sind tetraedrisch (Bindungswinkel von 108,5 Grad in einem dreidimensionalen Raum).
Methylchlorid hat ein zentrales Kohlenstoffatom, das von vier Einfachbindungen umgeben ist (drei zu Wasserstoff und eine zu Chlor). Daher hat das Molekül laut VSEPR eine tetraedrische Form mit einem Bindungswinkel von 108,5 Grad, um eine maximale Trennung der gebundenen Elektronen zu ermöglichen.