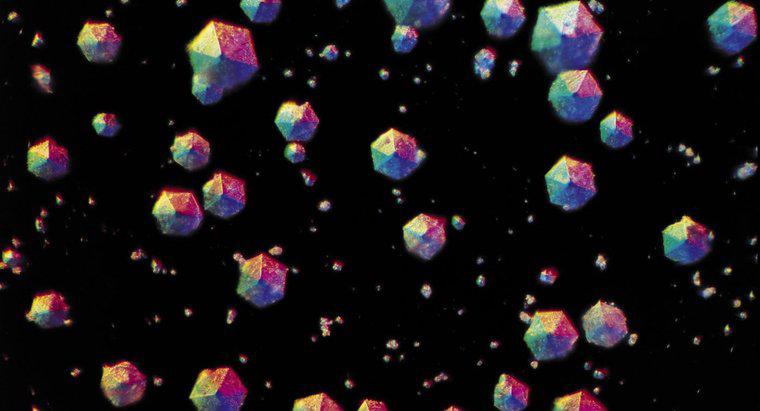Kristallisation trennt einen in einer Flüssigkeit gelösten Feststoff, der eine Lösung gebildet hat. Um den Feststoff zu kristallisieren, wird die Lösung in einem offenen Behälter erhitzt, damit die Flüssigkeit verdampfen kann und der kristalline Feststoff zurückbleibt.
Kristallisation kann natürlich oder künstlich herbeigeführt werden. Neben Kristallen, die aus einer flüssigen Lösung ausfallen, kann die Kristallisation auch in einer geschmolzenen Flüssigkeit, die abgekühlt wird, oder einem Gas, das auf einer Oberfläche abgelagert wird, erfolgen. Die Kristallisation erfolgt in zwei Hauptschritten: Keimbildung und Kristallwachstum.
Während der Keimbildungsphase werden die in der Lösung dispergierten Lösungsmittelmoleküle voneinander angezogen und bilden nanometergroße Cluster. Das Anhalten des Prozesses in dieser Phase und das Stabilisieren der Nanocluster ist eine häufig verwendete Technik bei der Synthese von Nanopartikeln. Das Fortsetzen des Prozesses führt zu stabilen Kernen, die bestehen bleiben, ohne sich wieder in der Lösung aufzulösen. Die kritische Größe, die diese Keime erreichen müssen, um stabil zu werden, hängt von den Systembedingungen wie der Lösungstemperatur und der Lösungsmittelkonzentration ab.
Die Kristallwachstumsphase beinhaltet das anschließende Anziehen zusätzlicher Lösungsmittelmoleküle an die Kerne, die zuvor eine kritische Größe erreicht haben. Dieser Prozess setzt sich so lange fort, wie die Lösung übersättigt ist: Es wird mehr Lösungsmittel gelöst, als es unter diesen besonderen Bedingungen aushalten kann.