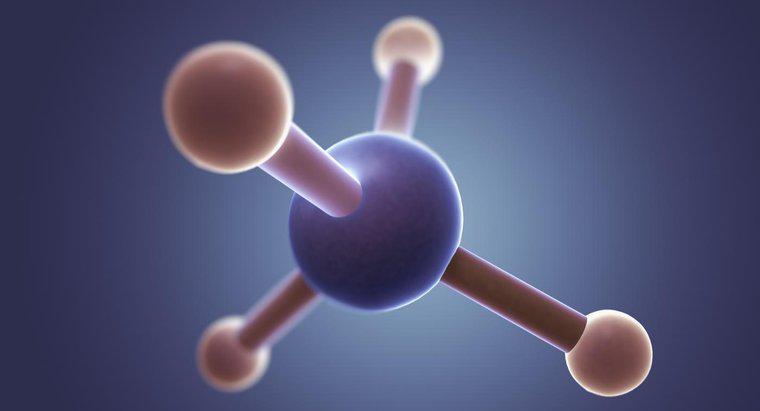
C2H2 hat eine geradlinige Molekülgeometrie, die aus einem Wasserstoffatom besteht, das an ein Kohlenstoffatom gebunden ist, das dreifach an ein zweites Kohlenstoffatom gebunden ist, das an ein zweites Wasserstoffatom gebunden ist. Der gebräuchliche Name für dieses Molekül ist Acetylen.
Acetylen bildet in Gegenwart von Luft ein explosives Gas. Die Dreifachbindung des Moleküls speichert eine große Menge an Energie, die leicht oxidiert, um ein stabileres Molekül zu bilden. Diese Oxidation erfolgt schnell, und die Freisetzung von Energie ist eine Explosion. Acetylen ist ein übliches Gas zum Betanken von Autogenbrennern von Schweißern. In Aceton gelöst, wird Acetylen viel weniger explosiv. Die Gasflaschen, die man in Schweißereien findet, enthalten diese Acetylen-Aceton-Lösung unter Druck. Calciumcarbid reagiert mit Wasser zu Acetylen. Alte Karbid-Bergmannslampen nutzen diese Reaktion, um Licht zu erzeugen. Der Bergmann verwendet ein Ventil, um die Tropfgeschwindigkeit des Wassers und die Menge des produzierten Gases zu steuern, das dann verbrennt, um Licht zu erzeugen. Industrielle Prozesse verbrauchen 80 Prozent des für die chemische Synthese produzierten Acetylens. Die restlichen 20 Prozent werden durch Schweißen verbraucht. Die Verwendung von Acetylen nimmt aufgrund der Nachfrage nach mehr Gas bei der Herstellung von Polyethylen-Kunststoffen zu. Phillips Petroleum arbeitet mit einem neuen Katalysator, um die Produktionseffizienz zu steigern und die Kosten für Acetylen zu senken.